As neoplasias malignas apresentam células com núcleos alterados: há irregularidades na forma, tamanho e número; podem surgir mitoses atípicas, hipercromasia nuclear (=grande quantidade de cromatina), pleomorfismo (variados tamanhos e formas de núcleo e da célula como um todo) etc. O citoplasma dessas células pode ter a relação núcleo/citoplasma alterada. Essas características microscópicas são consideradas índices de atipia.
Os tumores malignos e benignos possuem dois componentes: 1- parênquima que é constituído por células neoplásicas proliferantes ; 2- estroma de suporte que é constituído por tecido conjuntivo e vasos sanguíneos.
quarta-feira, 24 de novembro de 2010
INFARTO: Infarto agudo do miocárdio

Infarto é a morte das células de uma zona mais ou menos extensa do músculo que forma as paredes do coração, produzida pela falta de irrigação sanguínea.
Ó sintomas é uma dor opressiva, intensa e duradoura que se centra quase sempre atrás do esterno e se estende até os ombros e braços, sobretudo o ombro esquerdo e a parte interior do braço deste mesmo lado. Esta dor é acompanhada quase sempre de sintomas que não são específicos do infarto do miocárdio, tais como: sudorese abundante e frio, febre, náuseas e vômitos perturbações do ritmo cardíaco, e etc.O paciente se encontra ansioso e tem a sensação de uma morte iminente, essa dor pode durar mais de 20 minutos, as vezes, horas e até dias.
CÂNCER DE PRÓSTATA
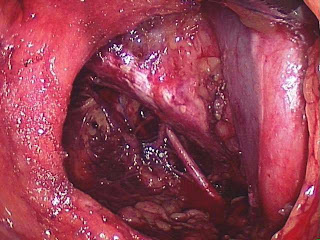
O câncer de próstata não é uma doença, mas muitos distúrbios que compartilham uma desregulação profunda do crescimento das células “crescimento novo”. Essas células se multiplicam rapidamente desordenadas de modo muito rápido e resistente ocorrendo uma formação de tumor.
O câncer de próstata é uma doença altamente prevalente no mundo inteiro. Em nosso país o rastreamento é preconizado em homens a partir dos 45 anos de idade através do toque retal e do PSA.
o câncer de próstata não produz sintomas nas fases iniciais. Com a evolução do problema podem surgir dificuldades para urinar, como jato fraco ou aumento do numero de micção. Esse sintoma aparentemente não afirma câncer maligno, pois nos beniguinos a sintomatologia é a mesma apenas exige uma avaliação médica.
A não-adesão de medidas de prevenção por parte dos homens leva ao aumento da incidência de doenças relacionadas a próstata, pois as variáveis culturas impedem os de freqüentar os consultórios médicos, fazendo com que a detecção do câncer seja descoberta tardiamente, impossibilitando o tratamento ainda na fase inicial da doença visando possíveis curas, pois o índice de mortalidade causado por câncer de próstata ainda se encontra alto.
Carcinógenos Químicos
As substâncias químicas cancerígenas são encontradas distribuídas na natureza, compreendendo desde alimentos naturais até compostos altamente modificados pelo homem. Os carcinógenos químicos são divididos em duas categorias: carcinógenos diretos e indiretos. Os diretos são agentes alquilantes que já possuem atividade eletrofílica intrínseca, e devido a essa propriedade podem provocar câncer diretamente. A maioria das substâncias químicas são carcinógenos indiretos, precisam primeiro sofrer modificações químicas no organismo para então se tornarem eletrofílicas e ativas (BOGLIOLO, 1998). O metabolismo dos carcinógenos é feito por grande variedade de enzimas solúveis ou associadas com membranas, entre as quais as do citocromo P-450 são as mais importantes. A atividade desses sistemas enzimáticos sofrem influências de vários fatores endógenos e exógenos. Há variações qualitativas e quantitativas dessas enzimas em diferentes tecidos, em diferentes indivíduos e diferentes espécies, podendo influenciar a região e o tipo de tumor (ROSSIT, 2001).
Os carcinógenos químicos se ligam ao DNA e causam mutações. O principal mecanismo de ação dos carcinógenos químicos é a formação de compostos covalentes com o DNA, que aumentam a probabilidade de ocorrerem erros durante a replicação. Nem sempre uma mutação resulta na formação de tumores, pois o organismo dispõe de sistemas eficazes de reparação de DNA.
sábado, 20 de novembro de 2010
HEMORRAGIA
A hemorragia indica extravasamento de sangue devido a ruptura de um vaso.
Todavia em quase todos os casos resulta de uma lesão vascular incluindo trauma, aterosclerose ou erosão inflamatória ou neoplásica devido a ruptura de um vaso.
Pode ser classificada numa variedade de padrões dependendo da extensão, tamanho ou localização do sangramento.
_acúmulo de sangue dentro de um tecido é chamado de hematoma.
_diminutas hemorragias de 1 a 2 mm na pele: petéquias.
_hemorragias maiores que 3mm é chamada púrpuras.
_hemorragias subcutâneas maiores que 1 a 2 cm de contusões são chamadas equimoses vistas após trauma.
_grandes acúmulos de sangue em outras cavidades recebem outra denominação:
-hemotoráx: (torax)
-hemopericárdio: (pericárdio)
-hemoperitônio: (peritônio)
-ou hemartrose: ( articulações).
O significado clínico da hemorragia depende do volume e da taxa de sangramento.
CURIODIDADES
Quando começa a vida...
“a ciência até hoje não consegui chegar a uma única resposta, neste caso são diversos as teses do exato momento em que se inicia a vida.
“as ciências dizem que começam com a fecundação, no momento em que espermatozóide entra no óvulo o que ocorre entre 12 e 48 horas após a relação sexual”.
 “com o início da atividade cardíaca para alguns cientistas a vida humana começa por volta da quarta semana de gestação, quando o coração começa a bater”.
“com o início da atividade cardíaca para alguns cientistas a vida humana começa por volta da quarta semana de gestação, quando o coração começa a bater”.“com a formação do sistema nervoso central que na quinta semana, o embrião já apresenta movimentos involuntários, o que indica atividade do sistema nervoso, característica primordial para a vida humana”.
“com o inicío da atividade cerebral considerando que uma pessoa é dada como no momento que o cérebro para, alguns pesquisadores apontam o inicío da vida para o instante em que as ondas cerebrais começam a entrar em ação na oitava semana’
“ Com a nidição ou implantação: esse momento o embrião se firma na parede do útero, daí surgirão os órgãos do corpo, dando assim, forma ao embrião: qüinquagésimo dia de gravidez’
‘com o surgimento do feto a teoria de que a vida humana se inicia na nona semana de gestação, e aí só aumentará de tamanho”
"CÉLULAS TRONCO"
CÉLULAS TRONCO...
Caracterizada por sua capacidade prolongada de auto renovação e por sua replicação assimétrica.
-Algumas se auto replicam, outras se diferenciam;
- pluripotentes/ embriões (células tronco embrionárias)
Estão presentes em muitos tecidos e contribui para homeostase.
Células tronco embrionárias
Dá origem aos tecidos do corpo, podem ser mantidas em cultura ou serem induzidas a diferenciação em linhagens diferentes. Além de tornar possível a produção de camundongos knouckout.
Para sua produção um gene específico é inativado ou deletado das células tronco cultivadas, injetadas no blastocisto e implantado no útero de uma mãe substituta, no qual podem no futuro repopular tecidos danificados como fígado (pós-necrose), ou miocárdio (pós-infarto
TIPOS DE CHOQUE
CHOQUE
O choque ou colapso cardiovascular é uma via comum de eventos clínicos potencialmente letais como hemorragia grave, trauma extensivo, queimaduras, infarto do miocárdio, embolia pulmonar ou sepse microbiana.
O choque dá origem a hipoperfusão sistêmica causada pela redução do debito cardíaco ou do volume sanguíneo circulante efetivo. Os resultados finais é uma hipotensão seguida de perfusão tecidual deficiente e hipóxia celular.
CHOQUE cardiogênico: resulta da falência da bomba miocárdica (infarto, arritmias ventriculares, tamponamento miocárdico) .
CHOQUE hipovolêmico: perda sanguínea ou volume plasmático.
CHOQUE séptico: infecção microbiana sistÊmica-(gran-negativo).
Nos casos mais raros pode ocorrer no cenário do acidente anestésico ou lesão da medula espinhal(choque neurogênico), devido a perda do tônus vascular e acúmulo periférico de sangue.
INFARTO
- é uma causa comum de morte associada a doença vascular em geral atribuída a infarto do miocárdio ou cerebral;
-envolve órgãos diferentes;
São classificados em cores:-
VERMELHOS: hemorrágicas (1) oclusão venosa-torção ovariana; (2) tecidos frouxos; (3) tecidos com circulações duplas; (4)tecido congestionado pelo fluxo venoso de drenagem lento;(5) fluxo reestabelecido ao local de oclusão e necrose arterial prévias.
-BRANCOS: anêmicos – oclusões arteriais em órgãos sólidos com circulação arterial em órgãos sólidos com circulação arterial terminal como (coração, pâncreas e rim).
A maioria dos infartos tende a apresentar uma forma de cunha, com o vaso ocluído no ápice e a periferia do órgão formando a base que quando serosa há um exsudato fibrinoso subrejacente.
Os infartos sépticos podem desenvolver-se quando a embolização ocorrer pela fragmentação de uma vegetação bacteriana de uma valva cardíaca ou quando os micróbios semeiam numa área de tecido necrótico.
domingo, 14 de novembro de 2010
sexta-feira, 5 de novembro de 2010
sábado, 30 de outubro de 2010
Tecido Nervoso - Regeneração
- Neurônios são continuamente formados ao longo da vida;
- Os novos neurônios provém de células-tronco (evento lento);
- A lentidão do processo pode impossibilitar reparo de grandes áreas;
- Os astrócitos e o epêndima podem atuar como células-tronco.
- Os novos neurônios provém de células-tronco (evento lento);
- A lentidão do processo pode impossibilitar reparo de grandes áreas;
- Os astrócitos e o epêndima podem atuar como células-tronco.
Reparo em osso
1d - Formação do Hematoma - Hemostasia (fibrina)
3d - Inflamação - PDGF, IL, TGF
1w - Colo mole - Granulação, matriz
3 - GW - Re - modelamento - Absorção (depósito, força, lame...)
3d - Inflamação - PDGF, IL, TGF
1w - Colo mole - Granulação, matriz
3 - GW - Re - modelamento - Absorção (depósito, força, lame...)
quinta-feira, 21 de outubro de 2010
Reparo dos tecidos
Envolve dois processos distintos: Regeneração e Fibroplasia ou Fibrose.
*Regeneração: Substituição das células lesadas por células do mesmo tipo.
*Fibroplasia ou Fibrose: Substituição das células lesadas por tecido conjuntivo.
Ambos os processos contribuem para o reparo.Tanto a regeneração quanto a fibroplasia são determinadas por mecânismos essencialmente similares, envolvendo a migração, proliferação e diferenciação celular, bem como interações entre célula e matriz extracelular (MEC).
sexta-feira, 15 de outubro de 2010
Reparo dos tecidos:
a) regeneração (substituição das células danificadas)
b) substituição por tecido conjuntivo = fibrose (cicatriz)
Controle do Crescimento Celular Normal –
Estímulos: morte celular, lesões ou deformações mecânicas dos tecidos.
Ciclo Celular e Potencial Proliferativo: G0; G1; S; G2; Mitose.
Ciclo Celular e Potencial Proliferativo: G0; G1; S; G2; Mitose.
1. Células lábeis: divisão contínua. Epitélios de superfície; epitélio gastrointestinal colunar e uterino; medula óssea e células hematopoéticas.
2. Células Estáveis (Quiescentes): baixo nível de replicação (necessitam de estímulo). São exemplos: células parenquimatosas (fígado, rim e pâncreas); células mesenquimatosas (fibroblastos e músculo liso) e células endoteliais vasculares.
2. Células Estáveis (Quiescentes): baixo nível de replicação (necessitam de estímulo). São exemplos: células parenquimatosas (fígado, rim e pâncreas); células mesenquimatosas (fibroblastos e músculo liso) e células endoteliais vasculares.
Obs. A regeneração celular pode não restabelecer a arquitetura original – se houver lesão da membrana basal a estrutura não é refeita originalmente.
3. Células permanentes: células nervosas e células da musculatura esquelética e cardíaca.
Eventos moleculares no crescimento celular –
Sinalizações intracelulares:
a) Autócrina: células respondem a sinalizações por elas mesmas produzidas – por exemplo em tumores e na hiperplasia epitelial.
b) Parácrina: células produzem moléculas que afetam uma célula-alvo em estreita proximidade. Por exemplo no reparo das feridas.
c) Endócrina: hormônios sintetizados por órgãos endócrinos atuando em alvos a longa distância (via corrente sangüínea).
a) Autócrina: células respondem a sinalizações por elas mesmas produzidas – por exemplo em tumores e na hiperplasia epitelial.
b) Parácrina: células produzem moléculas que afetam uma célula-alvo em estreita proximidade. Por exemplo no reparo das feridas.
c) Endócrina: hormônios sintetizados por órgãos endócrinos atuando em alvos a longa distância (via corrente sangüínea).
Receptores de Superfície Celular –
- Crescimento celular é mediado por ativações de receptores de superfície: um determinado fator de crescimento interage com um receptor contido no citoplasma, núcleo ou mesmo na membrana plasmática.
1. Receptores com atividade intrínseca quinase:
a. Domínio extracelular (para interação com o ligante)
b. Única região transmembrânica
c. Domínio citosólico: atividade tirosinoquinase e ou atividade serina-treonina.
d. Receptor de Insulina
e. Receptor de crescimento neuronal (NGF)
a. Domínio extracelular (para interação com o ligante)
b. Única região transmembrânica
c. Domínio citosólico: atividade tirosinoquinase e ou atividade serina-treonina.
d. Receptor de Insulina
e. Receptor de crescimento neuronal (NGF)
Exemplos de receptores tirosinoquinase: fator de crescimento epidérmico (EGF), fator de crescimento fibroblástico (FGF) e fator de crescimento plaquetário (PDGF) dentre vários outros.
São fatores diméricos que contém duas regiões para a ligação com o receptor formando um dímero de receptor: a molécula receptora fosforila a outra no dímero – haverá fosforilação cruzada dos resíduos de tirosina, sendo o “start” para ativação de uma cascata de fosforilações seqüenciais com ativação da seqüência gênica de consenso e ativação de fatores transcricionais como c-fos, ras, erb-1 – Após a dimerização do receptor haverá autofosforilação do mesmo = criação de sítios de ligação para uma série de proteínas citosólicas com domínio src (domínios de tirosina fosforiladas). O esquema abaixo mostra o funcionamento da via chamada de MAP-quinase, muito relevante no crescimento celular e regulação do metabolismo da mesma.
São fatores diméricos que contém duas regiões para a ligação com o receptor formando um dímero de receptor: a molécula receptora fosforila a outra no dímero – haverá fosforilação cruzada dos resíduos de tirosina, sendo o “start” para ativação de uma cascata de fosforilações seqüenciais com ativação da seqüência gênica de consenso e ativação de fatores transcricionais como c-fos, ras, erb-1 – Após a dimerização do receptor haverá autofosforilação do mesmo = criação de sítios de ligação para uma série de proteínas citosólicas com domínio src (domínios de tirosina fosforiladas). O esquema abaixo mostra o funcionamento da via chamada de MAP-quinase, muito relevante no crescimento celular e regulação do metabolismo da mesma.

2. Citocinas:
a. Receptores da superfamília de receptores acoplados a tirosinoquinase
b. Possuem um único segmento
c. Promovem fosforilações de quinases – STAT ativando resíduos de serina e treonina.
d. Via da jasnu-quinase: sistema JAK-STAT – quando houver ligação dos resíduos ativados pelo STAT no receptor há liberação do JAK.
a. Receptores da superfamília de receptores acoplados a tirosinoquinase
b. Possuem um único segmento
c. Promovem fosforilações de quinases – STAT ativando resíduos de serina e treonina.
d. Via da jasnu-quinase: sistema JAK-STAT – quando houver ligação dos resíduos ativados pelo STAT no receptor há liberação do JAK.
3. Receptores sem atividade catalítica intrínseca:
a. Domínio extracelular (ligante)
b. Uma única região transmembrânica
c. Domínio citosólico – associa-se diretamente a tirosinoquinases citosólicas. Por exemplo a superfamília das citocinas.
a. Domínio extracelular (ligante)
b. Uma única região transmembrânica
c. Domínio citosólico – associa-se diretamente a tirosinoquinases citosólicas. Por exemplo a superfamília das citocinas.
4. Receptores acoplados a proteína G:
a. Possuem 7 alças transmembrânicas
b. São exemplos os mais variados receptores: adrenérgicos, muscarínicos, dopaminérgicos, gabaérgicos, glutamaérgicos, etc.
a. Possuem 7 alças transmembrânicas
b. São exemplos os mais variados receptores: adrenérgicos, muscarínicos, dopaminérgicos, gabaérgicos, glutamaérgicos, etc.
Sistema de Transdução de Sinal –
- Sinais extracelulares – Sinais Intracelulares – MAP-quinase / PI-3 quinase / IP3 / AMPc / PLC / PLA2 / GMPc / JAK-STAT.

Regulação da Divisão Celular –
- Ciclinas (A,B,E).
- Conjunto de pontos de controle.
- Ciclinas executam suas funções ao formarem complexos com proteínas quinases ciclina dependente (CDK). Quando a célula passa para a fase G2 ocorre síntese de ciclina B que se liga a CDK1 constitutiva = entrada da célula na fase de mitose. Ciclina após realizarem sua atividade (fosforiladas) são degradadas pela via ubiquitina-proteassoma.
- As CDKs são reguladas por inibidores: p21 e p27 principalmente.
- A transição de G1-S é controlada pela fosforilação da proteína do retinoblastoma (Rb).
- A Rb seqüestra fatores de transcrição como o E2F – responsável pela transição da fase G0 para a fase G1. A medida que a célula progride no período G1 há aumento da ciclina D com ativação da CDK que hiperfosforila a proteína do retinoblastoma rompendo a ligação com E2F = entrada no período S do ciclo celular.
- Pontos de controle: mecanismos de vigilância – identificam os problemas na transcrição do DNA – por exemplo: ativação do p53 atuando e ativando, por sua vez, a p21, realizando a parada do ciclo celular e tentativa de reparo pelo GADD45. Se não houver o reparo a célula entrará em apoptose.
- Inibição do crescimento: inibição pode se dá por contato (célula-célula). Ativação do beta-TGF atuando sobre as fosforilações da serina e treonina quinase, SMAD e aumento do p27 diminuindo a taxa de CDK2 e conseqüentemente diminuindo a fosforilação do Rb.
- Fatores de Crescimento: importante na cicatrização de feridas. Podemos citar o EGF, alfa-TGF, PDGF (plaquetas), FGF, VEGF (vasculogênese) e beta-TGF.
- Conjunto de pontos de controle.
- Ciclinas executam suas funções ao formarem complexos com proteínas quinases ciclina dependente (CDK). Quando a célula passa para a fase G2 ocorre síntese de ciclina B que se liga a CDK1 constitutiva = entrada da célula na fase de mitose. Ciclina após realizarem sua atividade (fosforiladas) são degradadas pela via ubiquitina-proteassoma.
- As CDKs são reguladas por inibidores: p21 e p27 principalmente.
- A transição de G1-S é controlada pela fosforilação da proteína do retinoblastoma (Rb).
- A Rb seqüestra fatores de transcrição como o E2F – responsável pela transição da fase G0 para a fase G1. A medida que a célula progride no período G1 há aumento da ciclina D com ativação da CDK que hiperfosforila a proteína do retinoblastoma rompendo a ligação com E2F = entrada no período S do ciclo celular.
- Pontos de controle: mecanismos de vigilância – identificam os problemas na transcrição do DNA – por exemplo: ativação do p53 atuando e ativando, por sua vez, a p21, realizando a parada do ciclo celular e tentativa de reparo pelo GADD45. Se não houver o reparo a célula entrará em apoptose.
- Inibição do crescimento: inibição pode se dá por contato (célula-célula). Ativação do beta-TGF atuando sobre as fosforilações da serina e treonina quinase, SMAD e aumento do p27 diminuindo a taxa de CDK2 e conseqüentemente diminuindo a fosforilação do Rb.
- Fatores de Crescimento: importante na cicatrização de feridas. Podemos citar o EGF, alfa-TGF, PDGF (plaquetas), FGF, VEGF (vasculogênese) e beta-TGF.






Reparo por Tecido Conjuntivo (FIBROSE)
- A destruição tecidual: ocorre na inflamação necrosante (inflamação crônica) acometendo células parenquimatosas e estroma (tecido de sustentação).
- A substituição do tecido lesado por tecido conjuntivo denomina-se fibrose (cicatriz).
- Há várias etapas de cicatrização:
- Angiogênese
- Proliferação de fibroblastos
- Deposição de matriz extracelular
- Maturação e organização do tecido fibroso (remodelamento)
- Fatores de crescimento: no processo de remodelagem tecidual alguns fatores devem ser considerados como a regulação das metaloproteinases da matriz. Os fatores de crescimento estimulam a síntese de colágeno e de outras moléculas do tecido conjuntivo. A degradação do colágeno se dá pela ativação das famílias das metaloproteinases da matriz dependentes dos íons zinco para sua atividade. As metaloproteinases são colagenases intersticiais que clivam o colágeno fibrilar dos tipos I, II e III bem como a fibronectina; estromelisinas atuando sobre proteoglicanos, laminina, colágeno amorfo e fibronectinas. Uma vez formadas as metaloproteinases são rapidamente degradadas pela família dos inibidores teciduais específicos das metaloproteinases (TIMP) produzidos pelas células mesenquimatosas.
- A substituição do tecido lesado por tecido conjuntivo denomina-se fibrose (cicatriz).
- Há várias etapas de cicatrização:
- Angiogênese
- Proliferação de fibroblastos
- Deposição de matriz extracelular
- Maturação e organização do tecido fibroso (remodelamento)
- Fatores de crescimento: no processo de remodelagem tecidual alguns fatores devem ser considerados como a regulação das metaloproteinases da matriz. Os fatores de crescimento estimulam a síntese de colágeno e de outras moléculas do tecido conjuntivo. A degradação do colágeno se dá pela ativação das famílias das metaloproteinases da matriz dependentes dos íons zinco para sua atividade. As metaloproteinases são colagenases intersticiais que clivam o colágeno fibrilar dos tipos I, II e III bem como a fibronectina; estromelisinas atuando sobre proteoglicanos, laminina, colágeno amorfo e fibronectinas. Uma vez formadas as metaloproteinases são rapidamente degradadas pela família dos inibidores teciduais específicos das metaloproteinases (TIMP) produzidos pelas células mesenquimatosas.

- Angiogênese: logo após a lesão tecidual haverá o que chamamos de angiogênese (neoformação vascular) – ocorrerá proliferação de células endoteliais e fibroblastos – um novo tecido é formado: tecido de granulação (freqüentemente edemaciado); há formação vascular (vasculogênese) onde uma rede vascular primitiva é formada através de angioblastos; e um processo denominado angiogênese ou neovascularização onde vasos preexistentes dão origem a novos vasos.
Neste processo de neovascularização ocorrerá degradação da membrana basal do vaso original; migração de células endoteliais para estímulo angiogênico; proliferação de células endoteliais e subseqüente maturação destas células (remodelamento) e por fim, recrutamento das células periendoteliais para sustentar os tubos endoteliais (vasculares).
Neste processo de neovascularização ocorrerá degradação da membrana basal do vaso original; migração de células endoteliais para estímulo angiogênico; proliferação de células endoteliais e subseqüente maturação destas células (remodelamento) e por fim, recrutamento das células periendoteliais para sustentar os tubos endoteliais (vasculares).
Observe na figura abaixo os fatores envolvidos nestes processos acima descritos: VEGF atuando em receptores VEGF-R2 (promovendo a proliferação celular); VEGF-R1 promovendo a formação do tubo; estes dois processos determinam a vasculogênese enquanto que a angiogênese conta também com a ativação de angiopoetinas (Ang1-Tie2) para estabilização do vaso recém-formado; (Ang2-Tie2) tornando o endotélio mais responsivo ao controle negativo exercido pelo VEGF. Enquanto o processo de maturação ocorre fatores como PDGF e beta-TGF estão ativados.

Outros reguladores da angiogênese incluem as integrinas do tipo avß3 para manutenção dos vasos neoformados, motilidade e migração dirigida destas células; Trombospondinas 1, SPARC que desestabilizam as ligações entre células e matriz = angiogênese. Já as proteases (endostatinas) inibem a angiogênese (responsáveis pela remodelagem tecidual).
Processo de Fibrose (FIBROPLASIA) –
- Migração e proliferação de fibroblastos na lesão.
- Deposição de matriz extracelular.
- Deposição de matriz extracelular.
a) Proliferação de fibroblastos: há aumento de VEGF com formação de tecido de granulação responsável pelo aumento da permeabilidade vascular = formação de estroma provisório formado com crescimento de fibroblastos. Promovidos por IL-1, alfa-TNF, beta-TGF e PDGF.
b) Deposição de matriz extracelular: colágenos são importantes na resistência da cicatriz.
b) Deposição de matriz extracelular: colágenos são importantes na resistência da cicatriz.
Cicatrização das feridas –
- Processo inflamatório agudo – Regeneração parenquimatosa – parênquima + tecido conjuntivo – síntese de matriz extracelular – colagenização e resistência da ferida.
- Cicatrização por primeira intenção: incisões cirúrgicas e lacerações limpas, bordas são aproximadas e pequena quantidade de tecido fibroso é formado.
- Ocorre por exemplo num corte cirúrgico – preciso!
- Morte de um número limitado de células epiteliais e tecido conjuntivo
- Ruptura da membrana basal epitelial
- Espaço aberto é preenchido por sangue coagulado (crosta que recobre a ferida)
- 24h: Neutrófilos na margem da incisão – deslocam-se para os coágulos (interior)
- 48h: Células epiteliais projetam-se depositando membrana basal
- 72h: Neutrófilos trocados por macrófagos. Tecido de granulação invade o espaço da incisão – há grande produção de colágeno.
- 5° dia: Neovascularização máxima. Muito colágeno é observado na epiderme de espessura normal.
- 2ª Semana: Infiltrado de leucócitos, edema e eritema desaparecem. Há empalidecimento da incisão devido ao colágeno.
- Cicatrização por primeira intenção: incisões cirúrgicas e lacerações limpas, bordas são aproximadas e pequena quantidade de tecido fibroso é formado.
- Ocorre por exemplo num corte cirúrgico – preciso!
- Morte de um número limitado de células epiteliais e tecido conjuntivo
- Ruptura da membrana basal epitelial
- Espaço aberto é preenchido por sangue coagulado (crosta que recobre a ferida)
- 24h: Neutrófilos na margem da incisão – deslocam-se para os coágulos (interior)
- 48h: Células epiteliais projetam-se depositando membrana basal
- 72h: Neutrófilos trocados por macrófagos. Tecido de granulação invade o espaço da incisão – há grande produção de colágeno.
- 5° dia: Neovascularização máxima. Muito colágeno é observado na epiderme de espessura normal.
- 2ª Semana: Infiltrado de leucócitos, edema e eritema desaparecem. Há empalidecimento da incisão devido ao colágeno.
- Cicatrização por segunda intenção: lacerações com incapacidade de aproximação das margens da ferida, presença de material estranho, tecido necrótico e infecções. Vistas em grandes lesões epidérmicas.
- Há perda de grande quantidade de tecido, por exemplo em infartos ou abscessos, as células são incapazes de recompor a arquitetura original do tecido. Muito tecido de granulação é formado.
- Difere da cicatrização primária devido:
- Reação inflamatória mais intensa
- Quantidades bem maiores de tecido de granulação
- Contração da ferida: cicatriz resultante é bem discreta devido a grande atividade de contração (miofibroblastos)
- Há perda de grande quantidade de tecido, por exemplo em infartos ou abscessos, as células são incapazes de recompor a arquitetura original do tecido. Muito tecido de granulação é formado.
- Difere da cicatrização primária devido:
- Reação inflamatória mais intensa
- Quantidades bem maiores de tecido de granulação
- Contração da ferida: cicatriz resultante é bem discreta devido a grande atividade de contração (miofibroblastos)
Resistência da Ferida –
- Ao final da primeira semana pode-se remover as suturas – já temos 10% da resistência da pele original.
- Ao final da terceira semana – teremos 70-80% da recuperação da pele original.
- Ao final da primeira semana pode-se remover as suturas – já temos 10% da resistência da pele original.
- Ao final da terceira semana – teremos 70-80% da recuperação da pele original.
Aspectos que Influenciam na Cicatrização:
1. Nutrição (vitamina C ou zinco por exemplo)
2. Diabetes mellitus
3. Aterosclerose
4. Hormônios – glicocorticóides por exemplo
5. Infecções
6. Quimioterápicos e coagulopatias
7. Corpos Estranhos
8. Tamanho da Lesão
9. Fatores Mecânicos
1. Nutrição (vitamina C ou zinco por exemplo)
2. Diabetes mellitus
3. Aterosclerose
4. Hormônios – glicocorticóides por exemplo
5. Infecções
6. Quimioterápicos e coagulopatias
7. Corpos Estranhos
8. Tamanho da Lesão
9. Fatores Mecânicos

Aspectos patológicos no reparo das feridas –
1. Formação inadequada de tecido de granulação: ulceração (vascularização inadequada) e ou ruptura da ferida.
2. Formação excessiva dos componentes de reparo: excesso de colágeno pode originar uma tumefação elevada = quelóide. A proliferação inadequada de fibroblastos dará origem ao que chamamos de desmóides (fibromatoses agressivas).
3. Contraturas (observada em pele de queimados).
4. Deiscência do Ferimento (reabertura): herniações.
2. Formação excessiva dos componentes de reparo: excesso de colágeno pode originar uma tumefação elevada = quelóide. A proliferação inadequada de fibroblastos dará origem ao que chamamos de desmóides (fibromatoses agressivas).
3. Contraturas (observada em pele de queimados).
4. Deiscência do Ferimento (reabertura): herniações.

Processo de Cicatrização (seqüencial):
a) Limpeza e Preparação: retirada do exsudato inflamatório, fibrina e tecido necrótico;
b) Retração: miofibroblastos (aproximação e retração da ferida)
c) Tecido de granulação: tecido rico em fibroblastos, células endoteliais, neovascularização intensa. Tecido é mole, cavernoso, incolor de sangramento fácil.
d) Maturação: amadurecimento do colágeno depositado pelos fibroblastos, redução dos vasos sangüíneos e fibroplasia. Empalidecimento da ferida.
e) Reepitelização: epitélio regenera-se quando a membrana basal for recomposta.
f) Resistência: dada pelos miofibroblastos e colágeno (força tensil).
b) Retração: miofibroblastos (aproximação e retração da ferida)
c) Tecido de granulação: tecido rico em fibroblastos, células endoteliais, neovascularização intensa. Tecido é mole, cavernoso, incolor de sangramento fácil.
d) Maturação: amadurecimento do colágeno depositado pelos fibroblastos, redução dos vasos sangüíneos e fibroplasia. Empalidecimento da ferida.
e) Reepitelização: epitélio regenera-se quando a membrana basal for recomposta.
f) Resistência: dada pelos miofibroblastos e colágeno (força tensil).

sexta-feira, 24 de setembro de 2010
CLASSIFICAÇÃO DAS INFLAMAÇÕES

Dois padrões morfológicos de inflamação: acima, vemos uma inflamação aguda, com predominância de neutrófilos e necrose; abaixo vemos uma inflamação crônica, com células gigantes (CG), linfócitos (L) e grande quantidade de fibroblastos (F), indicativos da predominância da fase produtivo-reparativa. O critério de agudo ou crônico pode ser morfológico ou cronológico, mas é importante lembrar que nem sempre há coerência entre esses dois critérios (veja o texto ao lado).
Inflamação crônica
A inflamação crônica dura semanas, meses ou anos, enquanto a inflamação aguda tem curta duração, horas ou dias.
A inflamação aguda é caracterizada pelos fenômenos vasculares e exsudativos enquanto a inflamação crônica é caracterizada pelos fenômenos proliferativos, com formação de fibrose.
As possiveis evoluções da inflamação aguda são:
A inflamação aguda é caracterizada pelos fenômenos vasculares e exsudativos enquanto a inflamação crônica é caracterizada pelos fenômenos proliferativos, com formação de fibrose.
As possiveis evoluções da inflamação aguda são:
- Resolução
- Cura por fibrose
- Progressão para inflamação crônica
quarta-feira, 15 de setembro de 2010
CLASSIFICAÇÃO DAS INFLAMAÇÕES
Por resultarem em alterações morfológicas teciduais de diferentes características, as inflamações recebem classificações, estas podendo ser quanto ao tempo de duração ouquanto ao tipo de elemento tecidual predominante.
QUANTO AO TEMPO DE DURAÇÃO
Podem ser agudas ou crônicas, as primeiras tendo um curso rápido (entre 1 a 2 semanas) e as outras constituindo processos mais demorados (superam 3 meses). A variação entre os dois processos está diretamente vinculada aos fatores que influenciam a inflamação. Assim, de modo geral, diante de estímulos de intensidade na qual o hospedeiro consiga reagir de modo a tornar esse estímulo de curta duração, presenciar-se-á o aparecimento de exsudações plasmáticas e de neutrófilos, ambos característicos dos processos agudos. Por outro lado, a persistência do estímulo - exigindo uma reação diferente da anterior por parte do hospedeiro - promove um aumento dos graus de celularidade (principalmente dos elementos mononucleares), o que determina uma fase proliferativa e reparativa e, portanto, deinflamação crônica. Obviamente, existem casos em que há um curso agudo da inflamação, mas morfologicamente não se observam os elementos clássicos de uma inflamação aguda (intensa exsudação plasmática e presença de neutrófilos); em outras situações, ainda, pode-se observar que um quadro inflamatório crônico, que dura semanas, passa a exibir grande quantidade de neutrófilos e os sinais cardinais típicos da inflamação aguda; nesse caso, diz-se que a inflamação crônica se agudizou. Portanto, a relação cronológica e morfológica nem sempre é constante.
Inflamações agudas
"Resposta inflamatória imediata e inespecífica do organismo diante da agressão". |
A inflamação aguda é dita imediata por se desenvolver no instante da ação do agente lesivo, e inespecífica por ser sempre qualitativamente a mesma, independentemente da causa que a provoque.
"Reação tecidual caracterizada pelo aumento dos graus de celularidade e de outros elementos teciduais mais próximos da reparação, diante da permanência do agente agressor". |
A inflamação crônica é sempre precedida pela inflamação aguda, processo em que se desenvolvem as fases inflamatórias anteriormente citadas com o intuito de eliminar o agente agressor.
Clinicamente, nas inflamações crônicas não de observam os sinais cardinais característicos das reações agudas. Porém, todas as alterações vasculares e exsudativas que originam esses sinais clínicos continuam acontecendo, culminando com o destaque da última fase inflamatória, a fase produtiva-reparativa.
QUANTO AO TIPO DE ELEMENTO TECIDUAL PREDOMINANTE
Segundo Guidugli-Neto (1997), os diferentes quadros inflamatórios dependem da quantidade predominante dos seguintes elementos: exsudação, proliferação de células teciduais enecrose. A exsudação diz respeito à fase vascular e e exsudativa da inflamação; a proliferação de células teciduais indica a fase produtivo-reparativa; e a necrose, a fase degenerativo-necrótica. No tocante à inflamação aguda, a partir desses elementos, pode-se reconhecer pelo menos cinco tipos de inflamação:
1. Serosa: predomina a exsudação de líquido amarelo-citrino, com composição semelhante à do soro do sangue. Exemplos: pleurite, rinite serosa, bolha devido a queimadura etc.
2. Fibrinosa: predomínio de exsudato fibrinoso que origina, aliado à presença de tecido necrótico, placas esbranquiçadas principalmente sobre as mucosas e as serosas. A inflamação fibrinosa é também chamada de "inflamação pseudomembranosa", quando presente nas mucosas, pois apresenta essa camada superficial esbranquiçada sobre a área inflamada, como se fosse uma membrana. Exemplos: pericardite fibrinosa, inflamação diftérica etc.
3. Hemorrágica: assim classificada quando se observa o predomínio do componente hemorrágico no tecido inflamado. Exemplo: glomerulonefrite aguda hemorrágica.
4. Necrotizante ou ulcerativa: sempre presente nos focos inflamatórios como indicativa da irreversibilidade das lesões nos tecidos, apresentando exsudatos serosos, fibrinosos ou purulentos. A necrose pode ser causada pela agressão direta do agente ou pelos fatores citados quando na descrição da fase degenerativa-necrótica da inflamação. A ulceração se dá quando a necrose é superficial, levando à perda do revestimento epitelial.
5. Purulenta: também denominada de supurativa, esse tipo de inflamação é composto pelo pus, líquido de densidade, cor e cheiro variáveis, constituído por soro, exsudato e células mortas - principalmente neutrófilos e macrófagos. Pode se apresentar sob várias formas como pústula (circunscrita na epiderme), furúnculo (circunscrita no derma, sendo de origem estafilocócica),abscesso e flegmão (ou celulite).
Abscesso: cavidade neoformada encapsulada, com centro necrótico e purulento, parede interna com predomínio neutrofílico já em processo regressivo (essa parede é chamada de membrana piogênica uma vez que gera o pus) e camada externa com neovascularização e fenômenos exsudativos. Dessa última camada partem as respostas cicatrizantes ou de fibrose, dependendo da evolução do processo. Essas respostas estão diretamente ligadas à eliminação do agente etiológico (que é, geralmente, de origem infecciosa por bactérias piogênicas) e à saída da coleção de pus existente no local. Em relação ao último fator, podem-se realizar procedimentos de drenagem desse pus quando esta não está presente sob a forma de fístulas ou ulcerações no local.
Flegmão ou celulite: nesse tipo de inflamação purulenta não há formação da membrana piogênica, ou seja, a coleção de pus não se encontra concentrada em uma cavidade, mas sim, difusa sobre o tecido; além disso, há predominância dos fenômenos vasculares, com evidente eritema (hiperemia) e edema. O exsudato purulento é mais fluido, infiltrando-se no conjuntivo frouxo adjacente ao local inflamado. O flegmão é também chamado de celulite, nome dado para designar a inflamação do tecido subcutâneo.
Eventos celulares na transmissão neuromuscular
O potencial de ação nervoso se propaga pela fibra nervosa através de uma condução saltatória entre os nódulos de Ranvier até chegar ao ponto onde a fibra motora penetra no músculo. Após este ponto, a fibra nervosa não é mielinizada e o potencial de ação se propaga para os terminais da mesma forma que o faria em qualquer fibra amielinizada.
Os eventos relacionados à liberação de acetilcolina constituem um ciclo . Os passos distintos deste ciclo são enumerados a seguir.
Como acontece com os potenciais de ação comuns, há um pequeno influxo de Ca associado com o potencial de ação do terminal nervoso.
Como a superfície das membranas das vesículas são carregadas negativamente, a entrada de Ca neutraliza as cargas e provoca a aproximação das vesículas para a membrana pré-juncional.
A vesícula, em seguida, se funde espontaneamente com a membrana pré-sinaptica, liberando seu conteúdo de acetilcolina por exocitose.
A membrana da vesícula, agora incorporada na membrana pré-sinaptica, é tracionada de volta para o citoplasma por filamentos contráteis, os quais formam uma cesta ao redor da vesícula vazia.
As vesículas-cesto perdem seus cestos e formam uma cisterna. No interior desta cisterna , a acetilcolina é sintetizada pela ação da colinacetiltransferase, a partir da colina e acetil-CoA.
As vesículas que contém acetilcolina brotam desta cisterna. O ciclo inteiro, do (1) ao (6), é muito rápido e é da ordem de segundos ou no máximo de minutos.
Os eventos relacionados à liberação de acetilcolina constituem um ciclo . Os passos distintos deste ciclo são enumerados a seguir.
Como acontece com os potenciais de ação comuns, há um pequeno influxo de Ca associado com o potencial de ação do terminal nervoso.
Como a superfície das membranas das vesículas são carregadas negativamente, a entrada de Ca neutraliza as cargas e provoca a aproximação das vesículas para a membrana pré-juncional.
A vesícula, em seguida, se funde espontaneamente com a membrana pré-sinaptica, liberando seu conteúdo de acetilcolina por exocitose.
A membrana da vesícula, agora incorporada na membrana pré-sinaptica, é tracionada de volta para o citoplasma por filamentos contráteis, os quais formam uma cesta ao redor da vesícula vazia.
As vesículas-cesto perdem seus cestos e formam uma cisterna. No interior desta cisterna , a acetilcolina é sintetizada pela ação da colinacetiltransferase, a partir da colina e acetil-CoA.
As vesículas que contém acetilcolina brotam desta cisterna. O ciclo inteiro, do (1) ao (6), é muito rápido e é da ordem de segundos ou no máximo de minutos.
quarta-feira, 8 de setembro de 2010
Sinais da Inflamação
Calor: Perceptível nas superfícies corporais. Decorre da hiperemia e do aumento do metabolismo local;
Rubor: Hiperemia /Reflexo axônico (diminuição de impulsos vasoconstrictores);
"Tumor": Decorre do aumento da permeabilidade vascular (edema). Pode determinar aumento do volume hídrico local em até 5 ou 7 vezes.
Sinais Gerais
Embora seja considerada uma reação local, a inflamação suscita várias reações gerais em conseqüência de:
Ação direta de componentes do agente inflamatório (Antígenos, pirógenos, toxinas, etc...);
Liberação por células do foco inflamatório de substâncias de ação geral, durante a fagocitose, a histólise, a ativação do complemento, a coagulação do sangue;
a. Febre:
Conseqüências:
- Benéficas:
- Virulência e do crescimento bacteriano (muitas vezes pouco significativo...);
- Estímulo das defesas inespecíficas do organismo ("Fogo que purifica", de Hipócrates);
- Aumento da atividade fagocitária dos PMN;
- Aumento da produção de interferon;
- Aumento da glicólise, com aumento de ácido láctico e redução do pH, resultando em inibição do crescimento bacteriano e viral;
- Maléficas:
- Quando intensa e/ou prolongada, determina exaustão orgânica pelas modificações metabólicas que acarreta:
- Consumo do glicogênio hepático;
- Mobilização rápida dos ácidos graxos;
- Acetonemia e cetonúria;
- Aumento da eliminação urinária de nitrogênio,
- Redução da filtração glomerular;
- Retenção de cloretos;
- Depleção de potássio e fósforo.
b. Alterações hematológicas:
- Redução dos níveis séricos de Ferro:
- Leucocitose:
- Aumento da velocidade de sedimentação das hemácias
c. Reação dos órgãos linfóides:
Ocorre exaltação das funções do tecido linfóide, em conseqüência da estimulação extraordinária, por antígenos do agente inflamatório, que chegam às formações linfáticas regionais e às distantes através dos vasos aferentes ou pela circulação sangüínea.
d. Degeneração parenquimatosa:
Freqüente nas inflamações graves, tanto agudas como crônicas.
Trogocitose
É o processo pela qual linfócitos capturam fragmentos da membrana citoplasmática de células apresentadoras de antígenos expressando seus antígenos.
sexta-feira, 3 de setembro de 2010
CALCIFICAÇÃO METASTÁTICA
| ||
 calcificação metastática não tem sua causa primária fundamentada nas alterações regressivas teciduais, mas sim em distúrbios dos níveis sanguíneos de cálcio, ou seja, da calcemia. calcificação metastática não tem sua causa primária fundamentada nas alterações regressivas teciduais, mas sim em distúrbios dos níveis sanguíneos de cálcio, ou seja, da calcemia. |
 Dura-máter exibindo calcificações (setas) em duas áreas na foice cerebral. | A calcificação metastática é originada de uma hipercalcemia. Essa situação pode ser devida à remoção de cálcio dos ossos (comum em situações de cânceres e inflamações ósseas, imobilidade, hiperparatireoidismo) ou à dieta excessivamente rica desse íon. Aumentando os níveis de cálcio, imediatamente a relação desse íon e o fosfato é desequilibrada, o que contribui para a combinação de ambos e para a sua posterior precipitação nos tecidos que entram em contato com essas altas concentrações calcêmicas. |
Os tecidos calcificados metastaticamente — como pulmão, vasos sanguíneos, fígado e mucosa gástrica — podem ter sua função comprometida. Entretanto, a situação de hipercalcemia é mais preocupante clinicamente do que a calcificação em si. |
CALCIFICAÇÃO DISTRÓFICA
| ||
 A pinça destaca uma placa de ateroma calcificada, que se desloca da túnica íntima (PI). Esse quadro caracteriza um estágio avançado de ateroesclerose. |  omo o próprio conceito enfatiza, a calcificação distrófica se relaciona com áreas que sofreram agressões e que apresentam estágios avançados de lesões celulares irreversíveis ou já necrosadas. Nesse último caso, por exemplo, é comum observar calcificações distróficas nas paredes vasculares de indivíduos senis com ateroesclerose, cujo processo se caracteriza por presença de necrose no endotélio vascular devido à deposição de placas de ateroma. omo o próprio conceito enfatiza, a calcificação distrófica se relaciona com áreas que sofreram agressões e que apresentam estágios avançados de lesões celulares irreversíveis ou já necrosadas. Nesse último caso, por exemplo, é comum observar calcificações distróficas nas paredes vasculares de indivíduos senis com ateroesclerose, cujo processo se caracteriza por presença de necrose no endotélio vascular devido à deposição de placas de ateroma.A patogenia da calcificação distrófica ainda não está bem estabelecida; algumas teorias foram criadas em função dos fatores que regulam as calcificações normais, como a teoria dos sabões, aplicável para a ateroesclerose. |
Pontos de calcificação (basofílicos) na camada íntima da aorta em um processo avançado de ateroesclerose. Esses pontos calcificados podem se desprender da parede do vaso e cair na circulação sangüínea sob a forma de trombos. Esse fenômeno constitui uma complicação da calcificação distrófica (HE, 200X). Clique sobre a foto para ver uma placa de ateroma calcificada (PA) entre a túnica média (TM) e a túnica íntima (TI) (HE, 100X). | Esses fatores geralmente implicam a formação exagerada ou a secreção aumentada de fostato de cálcio e carbonato de cálcio, os quais são responsáveis pela formação inicial dos núcleo de calcificação. Os mais bem estudados são:
|
Veja leitura complementar sobre a calcificação distrófica na ateroesclerose | Sendo comum em áreas necrosadas, portanto sem função, a calcificação distrófica não traz maiores conseqüências para o local. É, antes de tudo, um sinal da existência de uma lesão prévia. Se, porém, ocorrer em locais com funções com mobilidade (por exemplo, as articulações sinoviais), pode comprometer essa atividade. Além disso, sua presença nos casos de ateroesclerose provoca deformações nos vasos, induzindo à trombose. |
 Calcificação distrófica (setas) na polpa dentária. Veja as diferenças morfológicas existentes entre as calcificações decorrentes de processos envolvendo lesões celulares e as calcificações encontradas naturalmente nos tecidos, como a dentina (D) (HE, 200X). | A calcificação distrófica pode estar presente no tecido pulpar com alterações regressivas. Essa situação é observada em casos de dentes com cáries, mal restaurados ou com doença periodontal. A calcificação nesses casos pode ser nodular ou difusa; em algumas situações, pode haver a formação de cálculos pulpares a partir desse núcleo inicial de calcificação distrófica. Clinicamente, a presença dessas calcificações no tecido pulpar podem levar a complicações irreversíveis, levando à extirpação total deste, como é o caso da figura ao lado. |
CALCIFICAÇÃO METASTÁTICA
| ||
 calcificação metastática não tem sua causa primária fundamentada nas alterações regressivas teciduais, mas sim em distúrbios dos níveis sanguíneos de cálcio, ou seja, da calcemia. calcificação metastática não tem sua causa primária fundamentada nas alterações regressivas teciduais, mas sim em distúrbios dos níveis sanguíneos de cálcio, ou seja, da calcemia. |
 Dura-máter exibindo calcificações (setas) em duas áreas na foice cerebral. | A calcificação metastática é originada de uma hipercalcemia. Essa situação pode ser devida à remoção de cálcio dos ossos (comum em situações de cânceres e inflamações ósseas, imobilidade, hiperparatireoidismo) ou à dieta excessivamente rica desse íon. Aumentando os níveis de cálcio, imediatamente a relação desse íon e o fosfato é desequilibrada, o que contribui para a combinação de ambos e para a sua posterior precipitação nos tecidos que entram em contato com essas altas concentrações calcêmicas. |
Os tecidos calcificados metastaticamente — como pulmão, vasos sanguíneos, fígado e mucosa gástrica — podem ter sua função comprometida. Entretanto, a situação de hipercalcemia é mais preocupante clinicamente do que a calcificação em si. |
EDEMA
|
 edema é resultado do aumento da quantidade de líquido nos meio extracelular, sendo externo aos meio intravascular. edema é resultado do aumento da quantidade de líquido nos meio extracelular, sendo externo aos meio intravascular. |
 Hidrodinâmica entre os compartimentos intersticial e intravascular. Na porção arteriolar, a pressão hidrostática é maior do que na porção venular, o que permite a saída de líquido pela arteríola e a entrada deste pela vênula. O líquido restante é drenado pela via linfática. | Normalmente, 50% da quantidade de líquido corpóreo se localizam na célula, 40% estão no interstício, 5%, nos vasos e os outros 5% compõem os ossos. Essa distribuição dos líquidos intersticial e vascular é mantida às custas da existência de uma hidrodinâmica entre esses dois meios, que mantêm uma troca equilibrada desses líquidos. O movimento do líquido do sistema intravascular para o interstício ocorre, em grande parte, devido à ação da pressão hidrostática do sangue. Essa saída do líquido do vaso se localiza na extremidade arterial da rede vascular. O seu retorno do interstício para o vaso se dá, principalmente, às custas da pressão oncótica sanguínea, aumentada na porção venosa. Durante essa dinâmica, fica uma certa quantidade de líquido residual nos interstícios. Esse líquido é drenado pelos vasos linfáticos, retornando depois para o sistema vascular. |
 Situação em que há um desequilíbrio provocado pelo aumento da pressão hidrostática, principalmente na porção arteriolar. A tendência é a maior saída de líquido para o meio extravascular, provocando o acúmulo deste no interstício. | O desequilíbrio entre os fatores que regem essa hidrodinâmica entre interstício e meio intravascular é que origina o edema. Esses fatores compreendem a pressão hidrostática sanguínea e intersticial, a pressão oncótica vascular e intersticial e os vasos linfáticos: 1) Pressão hidrostática sanguínea: quando essa pressão aumenta, ocorre saída excessiva de líquido do vaso, situação comum em estados de hipertensão e drenagem venosa defeituosa (por exemplo, em casos de varizes, insuficiência cardíaca etc). |
 Outra situação de desequilíbrio hidrodinâmico, agora provocado pela diminuição da pressão oncótica, principalmente da porção venular. Também ocorre a saída de líquido, acumulando-se no interstício. | 2) Pressão hidrostática intersticial: se diminuída essa força, o líquido não retorna para o meio intravascular, acumulando-se intersticialmente. 3) Pressão oncótica sanguínea: a redução da pressão oncótica provoca o não deslocamento do líquido do meio intersticial para o interior do vaso. Essa variação da pressão oncótica é determinada pela diminuição da quantidade de protéinas plasmáticas presentes no sangue. |
 Em casos especiais, pode haver a obstrução da via linfática, sem alteração nas pressões oncótica e hidrostática. O resultado também é o acúmulo de líquido no interstício em decorrência da falta de drenagem. | 4) Pressão oncótica intersticial: um aumento da quantidade de proteínas no interstício provoca o aumento de sua pressão oncótica, o que favorece a retenção de líquido nesse local. Além disso, o aumento dessa força contribui para a dificuldade de drenagem linfática na região. 5) Vasos linfáticos: se a função destes de drenagem dos líquidos estiver comprometida, pode surgir o edema. Esse quadro é observado, por exemplo, em casos de obstrução das vias linfáticas (ex.elefantíase). 6) Acúmulo de sódio no interstício: ocorre quando há ingestão de sódio maior do que sua excreção pelo rim; o sódio em altas concentrações aumenta a pressão osmótica do interstício, provocando maior saída de água do vaso. |
Edema pulmonar. Observe como o líquido (substância roséa) se acúmula nos espaços aéreos, provocando a total desorganização tecidual (HE, 100X). Clique sobre a foto e observe, em maior aumento, a presença de células inflamatórias (setas) por entre o líquido acumulado (HE, 200X). | Os edemas podem aparecer sob duas formas: localizado e sistêmico. O exemplo clássico de edema localizado é o edema inflamatório, cuja constituição é rica em proteínas. Daí o líquido desse tipo de edema ser denominado de "exsudato". O edema inflamatório está descrito no capítulo sobre Inflamações. O edema sistêmico é formado por líquido com constituição pobre em proteínas. Esse líquido é denominado de "transudato", estando presente, por exemplo, no edema pulmonar. O significado clínico dos edemas sistêmicos reside no fato de que a presença desses líquidos pode originar infecções, trazendo complicações maiores para o local afetado. Assim, os edemas pulmonares podem originar pneumonias e insuficiência respiratória; o edema cerebral, por sua vez, pode ser mortal. |
Assinar:
Postagens (Atom)



















